ESTRUCTURA ATÓMICA
Se planteó muchas ideas sobre el átomo desde tiempos muy antiguos, el ser humano llevado por la curiosidad, siempre ha tratado de explicar entre otras cosas, cuál es la parte más pequeña en la que se fundamenta la materia, y es así que una de esas preguntas se resuelve hasta cierto punto cuando se busca sobre "la mínima porción de materia con capacidad de combinación", pues ha esta pregunta la respuesta sería el átomo.
Si bien es cierto la palabra átomo de por si, tiene un significado etimológico de "indivisible", esto hoy en nuestros días, solo es eso, "un significado", más no su definición, pues el átomo en si, es un sistema dinamico en equlibrio eléctrico.
¿Cuál es la estructura atómica del átomo?
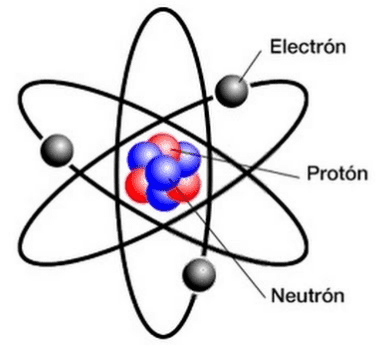
La estructura atómica del átomo, esta basada en el modelo mecánico cuántico, que es lo que más se emplea hoy en día para estructurarlo. Así, lo representamos de la siguiente forma:
La parte central del átomo representado por esferas rojas y azules, se le conoce como núcleo atómico o simplemenete "nucleón", mientras que la zona que rodea al núcleo atómico se le conoce como zona extranuclear y contiene unicamente a unas partículas conocidas como electrones - representadas por esferas grises- las cuales estan cargadas negativamente, y estas en sus desplazamientos genera un "nube de energía" a la que se le conoce como "nube electrónica".
La zona extranuclear es una región negativa por los electrones que generan la nube electrónica, aunque en términos prácticos, se asume que zona extranuclear y nube electrónica, son idénticos.
El átomo contiene de las muchas partículas subatómicas que se conocen, a solo tres tipos de ellas, estos son denominados como particulas subatómicas fundamentales del átomo, y la tenemos aquí:
La diferencia entre una partícula subatómica fundamental y una elemental radica en su composición, por tanto una partícula fundamental esta compuesta por otras más pequeñas conocidas como "Quarks", tal como el protón o el neutrón; mientras una partícula elemental no esta constituida por estructuras más pequeñas, tal es el caso del electrón o el positrón mismo.
Veamos en el cuadro siguiente, algunas propiedades de las partículas subatómicas que existen generalmente en el átomo:
Estos datos, nos permiten representar al átomo, a nvel de su nucleo, con la siguiente notación para nuclidos:
Donde:A representa a la cantidad de nucleones - aquí se concentra el 99,99...% de la masa del átomo- por lo que también se denomina número de masa. Por tanto podríamos formular lo siguiente: A = #p + #n
Por ejemplo, si el átomo de Sodio tiene 11 protones y 12 neutrones, el numero de masa seria la suma de las cantidades de los protones y los neutrones, es decir, de lo formulado:
A = #p + #n, entonces: A = 11 + 12 = 23
Z representa al número atómico - siempre igual a la cantidad de protones (#p)- el cual identifica al átomo y por tanto la ubicación del elemento químico en la tabla periódica de la cual forma parte. Entonces, con lo formulado anteriormente, podríamos emplear también lo siguiente: A = Z + #n
Por ejemplo, el átomo de Bromo tiene número de masa 80 y su número atómico es 35, entonces la cantidad de neutrones, se puede calcular empleando la formula:
A = Z + #n, reemplazamos: 80 = 35 + #n, y obtendremos que el: #n = 45
Los átomos se nos pueden mostrar en dos estados, estos son:
- Átomo neutro: Aquellos, donde existe un equilibrio eléctrico, por tanto la cantidad de protones y electrones son iguales, por tal razón a estos átomos se le conocen solamente como "Átomos". Aquí se cumple: #p = #e = Z
- Átomo eléctrico: Aquellos, donde existe un desequilibrio eléctrico, por tanto la cantidad de protones y electrones son distintas, a estos tipos de átomos eléctricos se les conoce como "Iones". En este contexto, encontramos dos tipos de Iones:
- Catión: ion positivo, generado por la perdida de electrones en relación a sus protones, así si tenemos un átomo neutro con 5 protones, su cantidad de electrones también será 5, pero si esta pierde 3 electrones, entonces dicho atomo será ahora un catión con carga +3, denominándose tri catión, y además tendrá 2 electrones debido a la perdida.
- Anión: ion negativo, generado por la ganancia de electrones en relación a sus protones, así si tenemos un átomo neutro con 8 protones, su cantidad de electrones también será 8, pero si esta gana 2 electrones, entonces dicho átomo será ahora un anión con carga -2, denominándose di anión, y además tendrá 10 electrones debido a la ganancia.
Los iones se generan basicamente por la variación de la cantidad de sus electrones.
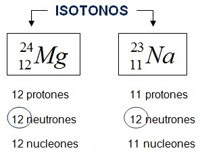
Por otro lado, como existen una gran variedad de átomos, los científicos para un mejor análisis de su comportamiento, optan por "compararlos", es así por ejemplo que ha átomos con igual cantidad de neutrones se les conoce como isótonos (de: iso=igual, tono=neutrón | El término isótono fue dado por el Físico Alemán Guggenheimer al reemplazar la "p" (de "protón") en "isótopo" por una "n" de "neutrón"). Para un mejor detalle veamos el siguiente cuadro:
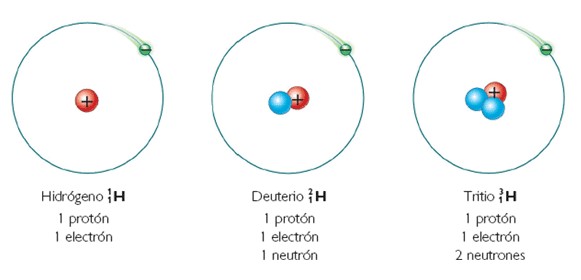
Respecto de los isótopos, estos átomos pertenecen a un elemento químico en particular, es decir, cada elemento esta conformado por isótopos. Por ejemplo el elemento químico más simple conocido, es el Hidrógeno, y esta conformado por tres isótopos, los cuales son:
Al isótopo de la izquierda, se le conoce tambien como protio. Por otra parte, existen - de acuerdo al cuadro anterior- átomos con igual numero de masa conocidos como isobaros, como:
Los isótonos como:
Los isoelectrónicos son especies atómicas con igual numero de electrones, y que además poseen la misma configuración electrónica, razón por el cual sería para otro post. Por cierto, en nuestro canal de EDUCATIDE® te explico algunas resoluciones sobre este tema tan interesante. Aquí el video:
Muy bien, espero que hayas pasado un rato agradable, afinando tus conocimientos, y, ya sabes no olvides que si tuvieras algún comentario, o duda, puedes hacerlo en la caja de comentarios, situado en la parte de abajo del post. Hasta pronto.




.gif)






Comentarios