ESPECTROSCOPIA
Existen diferentes técnicas de monitoreo y control del medio ambiente, como es el caso de la polución por compuestos orgánicos volátiles, pero es la Espectroscopia la que tiene una mayor ventaja potencial al proveernos de escaneados simultáneos de las longitudes de onda en regiones del Espectro como la Infrarroja, IR (radiación de mayor longitud de onda que la luz visible, y no observable por el ojo humano), la cual permite la detección de diversos compuestos químicos, pero a todo esto, ¿Qué es un Espectro?, pues un ESPECTRO puede conceptuarse como la representación gráfica de un conjunto de radiaciones electromagnéticas (REM) absorbidas o emitidas, las cuales están ordenadas en función a sus longitudes de onda, frecuencia o energía. En el análisis espectral, el espectro energético es la imagen representada por un registro gráfico que se observa en un sistema físico al ser excitado para luego ser analizado, estos sistemas pueden ser desde estrellas hasta moléculas, átomos, minúsculos corpúsculos que debido a su actividad generan energía. Los sistemas físicos generan energía que pueden ser de dos tipos: EMISIÓN si el registro es producido por una muestra excitada y de ABSORCIÓN si la muestra es irradiada con una banda de frecuencia adecuada evaluándose por defecto las frecuencias que han sido absorbidas por la muestra.
ESPECTROSCOPIA
Es el estudio de la interacción entre la radiación electromagnética (REM) y la materia, con absorción o emisión de energía radiante, en tal sentido la espectroscopia relaciona a los espectros con la estructura atómica o molecular de la sustancia; así cada elemento o compuesto presenta un espectro único y particular que le sirve a manera de "huella digital", permitiendo identificar a diversas sustancias que contiene una muestra, aunque esto involucre encontrar trazas de ellos.
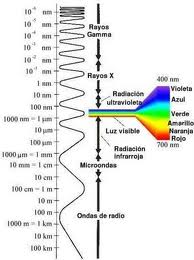
ESPECTRO ELECTROMAGNETICO
Es el conjunto de las diversas clases de ondas electromagnéticas (OEM) que al ser tan variadas es necesario considerarlas en orden generalmente creciente a sus longitudes de onda o según su frecuencia (proporcional a la energía), esta última es inversa a la longitud de onda.
Del espectro electromagnético se puede observar lo siguiente:
- La radiación electromagnética (REM) de mayor longitud de onda y de menor frecuencia (y energía) son las ondas de radio, mientras que la REM de menor longitud de onda, pero de máxima frecuencia son las radiaciones cósmicas (que en la gráfica se ubicaría justo en la parte superior de los rayos gamma con una longitud de onda promedio de 10–5nm).
- La fuente de radiación principal de las REM son: el SOL de reacción nuclear para los rayos cósmicos. La DESINTEGRACIÓN NUCLEAR para los rayos gamma. La DESINTEGRACIÓN NUCLEAR y la TRANSICIÓN ELECTRÓNICA en niveles internos de un átomo para los rayos "X". La TRANSICIÓN ELECTRÓNICA en niveles internos de un átomo para la radiación ultravioleta (UV). La TRANSICIÓN ELECTRÓNICA en niveles externos de un átomo para la Luz visible. La TRANSICIÓN ELECTRÓNICA y la VIBRACIÓN MOLECULAR para la radiación infrarroja (IR). La ROTACIÓN MOLECULAR para las microondas. La ROTACIÓN MOLECULAR y RADIOTRANSMISORES para el radar. Los RADIOTRANSMISORES para TV VHF, UHF, celulares, radio FM, onda corta, radio AM y onda larga. El COMPUTADOR para micropulsos.
- Cada tipo de REM tiene diversas aplicaciones dentro de la ciencia y la tecnología, así los rayos "X" hoy denominados rayos "Röentgen" se emplean en medicina, análisis cristalográficos, bioquímica, solo por citar un ejemplo.
- La ondas Hertzianas comprenden desde los rayos Infrarrojo (IR, de calor) hasta las ondas de radio.
Dentro del espectro electromagnético, el cual es tan amplio, existe una estrechisíma banda comprendida entre los 390nm y 700nm de longitud de onda, los cuales son sensibles a nuestros ojos, de este modo permiten la visión de los cuerpos que la emiten, este conjunto de radiaciones forman el Espectro Luminoso o "Espectro Visible". Si se hace pasar un haz de lus solar (luz blanca) a través de un prisma de vidrio (o rejilla de difracción) se observa sobre al extremo para una placa fotográfica una banda coloreada semejante al arco iris, donde cada color implica una radiación monocromática, siendo esta descomposición de la luz denominada "fenómeno de dispersión de la luz", siendo la banda coloreada el espectro visible, pues esta la podemos percibir. El espectro visible es "continuo" pues entre la banda de colores no existe ninguna sombra oscura.
 |
| Espectro visible |
Del grafico podemos deducir que la luz monocromática roja es la que presenta mayor longitud de onda (pero menor frecuencia, por tanto energía minima), mientras que la luz monocromática violeta presenta menor longitud de onda (pero mayor frecuencia, por tanto energía máxima). El color de un cuerpo material es de color rojo si al ser irradiado con la luz solar, refleja la radiación roja y absorbe las demás radiaciones monocromáticas, en el caso del color violeta este se manifiesta si al ser irradiado con la luz solar, refleja la radiación violeta absorbiendo las demás radiaciones monocromáticas, empero un cuerpo es de color negro si absorbe todas las radiaciones monocromáticas, no flejando ninguna de dichas radiaciones monocromáticas, en el caso del color blanco este refleja todas las radiaciones monocromáticas.
TIPOS DE ESPECTRO:
ESPECTRO CONTINUO.- Son aquellos que se emiten por los materiales incandescentes en estado condensado (sólidos o líquidos) y gases a alta presión, siendo sus características independientes del material que emite la radiación: El espectro contiene todas las longitudes de onda correspondientes a una región específica del espectro electromagnético, como es la luz visible, así tenemos el arco iris el cual es un espectro continuo de la luz blanca.
ESPECTRO DISCONTINUO.- Cuando las muestras gaseosas a baja presión son sometidas a descargas eléctricas para luego hacer que la luz emitida por el gas se disperse, estas generaran un espectro de líneas discontinuas, que en este caso se denominan "espectro de emisión".
ESPECTRO ATÓMICO DEL HIDRÓGENO
ESPECTRO DE ABSORCIÓN.- Es el que se logra obtener después de haber hecho pasar a través de una sustancia, un espectro continuo, partes de las radiaciones del espectro continuo faltan o son debilitadas a causa de la absorción observándose líneas oscuras sobre un fondo blanco.
ESPECTRO DE EMISIÓN.- Es el que se logra obtener de un foco emisor sin interponer en su trayectoria materia alguna (excepto aire). En nuestro caso el hidrógeno atómico excitado (sometido a una descarga eléctrica) emite luz y ésta se descompone en un prisma, para luego observarse en la placa fotográfica un conjunto de lineas brillantes sobre un fondo oscuro, este espectro de emisión se denomina espectro de líneas. La experiencia en un inicio se desarrollo a finales de la década de 1850 por KIRCHOFF y BUNSEN.
El espectro que caracteriza a cualquier elemento se obtiene mediante un dispositivo denominado "Espectrómetro o Espectrógrafo", en el caso de los sólidos incandescentes estos generan espectros continuos (espectro visible), ciendo las sustancias moleculares las que generan "Espectros de bandas", donde cada banda esta constituida por un conjunto de líneas finas muy juntas, pero separables con espectroscopios de alto poder de resolución.
RELACIONES ESPECTROSCÓPICAS
 Un elemento químico en estado gaseoso incandescente o excitado por una descarga eléctrica, emite una radiación que constituye su espectro atómico de emisión mediante una brillantez que le es característico; estos espectros se caracterizan por ser discontinuos, estando constituidos por líneas (rayas) luminosas de frecuencias definidas separadas por zonas oscuras, cada elemento da lugar a un espectro propio gracias al cual se le puede identificar. El Astrónomo JANSSEN en 1868 durante un eclipse solar observó que las rayas obtenidas no podrían atribuirse a ningún elemento conocido en la Tierra, esa "raya" se adjudicó a un elemento nuevo, el HELIO (He), del griego "helios = sol". El espectro del Hidrógeno es el más simple de todos los elementos, si observamos detenidamente su espectro de emisión se observará lo que J. J. BALMER descubriría en 1885, grupos de líneas, que reciben el nombre del científico que los descubrió, en este caso BALMER descubriría la región del espectro VISIBLE.
Un elemento químico en estado gaseoso incandescente o excitado por una descarga eléctrica, emite una radiación que constituye su espectro atómico de emisión mediante una brillantez que le es característico; estos espectros se caracterizan por ser discontinuos, estando constituidos por líneas (rayas) luminosas de frecuencias definidas separadas por zonas oscuras, cada elemento da lugar a un espectro propio gracias al cual se le puede identificar. El Astrónomo JANSSEN en 1868 durante un eclipse solar observó que las rayas obtenidas no podrían atribuirse a ningún elemento conocido en la Tierra, esa "raya" se adjudicó a un elemento nuevo, el HELIO (He), del griego "helios = sol". El espectro del Hidrógeno es el más simple de todos los elementos, si observamos detenidamente su espectro de emisión se observará lo que J. J. BALMER descubriría en 1885, grupos de líneas, que reciben el nombre del científico que los descubrió, en este caso BALMER descubriría la región del espectro VISIBLE.







Comentarios