TEORÍAS Y MODELOS ATÓMICOS I
El hombre es un ser de necesidades, cuyo interés es de conocer y explicar la naturaleza de los cuerpos que forman parte de su medio y para lograr su comprensión es necesario una alta elucubración mental cuyo principio básico es la observación, y esto se dio en la antigua Grecia, me es poco posible precisar el inicio de las Ciencias Químicas, pero se sabe que su origen fue en Egipto y obviamente Grecia, bajo las siguientes evidencias históricas y filosóficas:
- Thales de mileto, en el año 600a.C. consideró al agua como elemento original de todas las sustancias.
- Anaxímenes, 585a.C. consideró al aire como el germen de formación de todos los seres.
- Heráclito, 535a.C. consideró al fuego como la sustancia esencia de formación de todo lo que nos rodea.
- Jenófanes, 570a.C. consideró a la tierra como la sustancia de toda la materia.
- Empédocles, 490a.C. consideró cuatro raíces: agua, tierra, aire y fuego.
Empero, la existencia de una partícula tan pequeña que por su tamaño no podría ser dividida fue la obsesión de un grupo muy reducido de antiguos filósofos Griegos cuya idea podían explicarlas, más no con un sustento científico, a estos filósofos se les conoció como los "Atomistas", de cuyos escritos originales se han perdido, a razón de que sus ideas no eran influyentes y por el cual fuerón perseguidos por los que creían en otras corrientes filosóficas, pero son estos oponentes los que dejarón escritos en los que sobresale un poema hecho por el epicurísta Romano Leucipo la cual se titula "De Rerum Natura" o "Sobre la Naturaleza de las Cosas", pero es de su "discípulo" el filósofo Griego Demócrito (discipulo además de los epicureos y de algunos magos persas) del cual se tiene demostrada su existencia entre los años 460a.C - 370a.C, contemporáneo de Sócrates, fue junto a "Leucipo" fundadores de esta escuela "Atomista". Demócrito, nacido en Abdera de Tracia, en Grecia, trató de explicar del porque diferentes cuerpos presentaban distintas densidades, tal era el caso de la roca y la madera los cuales colocados en el agua, era la roca la cual se iba al fondo más no la madera; despues de una serie de "observaciones y análisis" de distintas sustancias bajo él argumento de la Lógica concluyó: "Las sustancias menos densas tienen en su interior más huecos o espacios vacíos (VACUUM o Kennon)", es este pensamiento lo que determina para él, que la materia no es un todo continuo, es DISCONTINUA, es decir presentan partes, estas PARTES son indivisibles, inmutables, indestructibles, impenetrables, macizos, homogéneos, eternos y de constante movimiento por lo que decía: "Todo lo que nos rodea no es sino un efecto de las distintas posiciones, tamaños, formas y movimientos de los Átomos (PARTES)", la idea de ATOMO (del griego: A = sin; Tomo = partes) le pertenece a DEMÓCRITO (de la ciudad de abdera), así esta idea se puede plasmar en el hecho de que la subdivisión continua de la materia generara pequeñas partículas que no admitan división, a esta partículas se denominarán átomos, bajo este criterio Demócrito de Abdera postula la "división finita o discontinua de la materia"; Por el siglo XVII, Sir Isaac Newton aceptaba la idea de Demócrito, en los siguientes términos: "Me parece probable que Dios creara la materia en forma de partículas móviles, impenetrables, duras macizas y tan resistentes que nunca se gastarán o rompieran en pedazos", pero tuvierón que pasar más de 2 000 años para que otros estudiosos de la materia interna corroboraran en cierta forma las ideas de Demócrito.
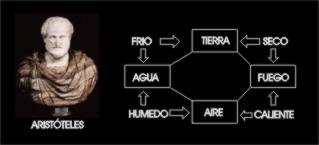
Aristóteles, 384a.C - 322a.C, considerado un filósofo Oscilante, introdujo el concepto de la transmutación de los elementos, para lo cual considero cuatro principios abstractos: seco - húmedo, caliente - frío, y el éter (sustancia invariable que todo lo penetra y en todo lugar se encuentra), que al combinarse generarian elementos fundamentales: Tierra, Fuego, Aire y Agua.
TEORÍA ATÓMICA DE JOHN DALTON
La actual teoría atómica tiene como base una serie de sustentos científicos teóricos y experimentales realizados a razón de muchas observaciones y mediciones de los cuales algunos como Robert Boyle, A. L. Lavoisier (Ley de la conservación de la masa, año: 1785), J. B. Richter (Ley de las proporciones recíprocas, año: 1791), Proust (Ley de las proporciones definidas o constantes, año: 1799), merecen ser reconocidos por sus aportes que sirvierón para sentar la primera teoría científica de la estructura del átomo desarrollada entre 1803 y 1808 por el Físico y Químico Inglés John Dalton (1766 - 1844), del Manchester, el cual estableció una "hipótesis" sobre las sustancias y de que estas estan constituidas de pequeñas partículas indivisibles denominadas ÁTOMOS. Considerado "Padre de la Teoría Atómica", Dalton es autor de la primera teoría atómica con bases científicas, en 1803 sustentó su trabajo basado en la estructura de la materia, la cual fué publicada posteriormente en 1808 con el título de "New System of Chemical Phylosophy" en la cual plantea diferentes hipótesis para explicar numerosos hechos de una forma sencilla (tal es el caso que introduce símbolos arbitrarios para designar a los elementos) y bajo el rigor de la lógica fundamentada en los análisis cuantitativos experienciales desarrollados anteriormente por los científicos ya mencionados.
Los postulados (o conclusiones) más importantes de su teoría atómica son:
- Toda la materia está constituida por átomos, estos son partículas elementales pequeñisímas de esferas sólidas compactas, indestructibles e indivisibles.
- Todos los átomos de un mismo elemento son iguales entre si, en todas sus propiedades, fundamentalmente en tamaño (volumen) y peso (masa).
- Los átomos de elementos diferentes tienen pesos y propiedades distintas.
- Los átomos se combinan (reacción química) con otros átomos para formar átomos compuestos de compuestos químicos y lo hacen siempre en números enteros, en proporciones fijas y sencillas, estos no se crean ni se destruyen, solamente cambian de distribución, por tanto en una reacción química existe reordenamiento de átomos, que permanecen inalterados por más violenta que sea la reacción.
- Los átomos de elementos distintos pueden combinarse en más de una relación.
- Si dos elementos pueden formar únicamente un compuesto conocido éste tiene que estar constituido solamente por un átomo de cada elemento, por tanto los compuestos tienen átomos combinados de arreglos definidos, de forma que el número de átomos de un elemento en un compuesto es limitado o definido.
De lo observado podemos notar que Dalton nunca aceptaría la idea que existiera una molécula formada por átomos idénticos como: H2, O2, P4, O3, S8, ..., razón por el cual se opuso a la ley experimental de L. J. Gay-Lussac (Ley de volúmenes de combinación para gases, año: 1802). Aún así la teoria de Dalton fue la base del desarrollo de la Química moderna, según Engels "La nueva era de la Química comienza con la teoría atómica".
OBSERVACIÓN: Actualmente la teoria de Daltón presenta serias falencias, así a inicios de nuestro siglo XXI, se sabe experimentalmente que el átomo esta constituido de partículas denominadas subatómicas, las cuales debido a su cantidad se dividen en dos familias principales, los Hadrones y los Leptones por otra parte F. Soddy definió a los isótopos como átomos de un mismo elemento con propiedades físicas distintas. Respecto de la inmutabilidad del átomo "aún en las reacciones más violentas" esto constituye una incoherencia, pues en las reacciones nucleares los átomos alteran su identidad.
A mediados del siglo XIX, en el campo de la Física se produjerón descubrimientos trascendentales que harían que los científicos de la época dudaran de la teoría de la indivisbilidad del átomo de Dalton, estos descubrimientos son: la electrólisis, los rayos catódicos, el efecto fotoeléctrico, los rayos canales, los rayos "X", la radioactividad y los progresos desarrollados en el campo de la espectroscopía principalmente.
DESCUBRIMIENTO DEL ELECTRÓN
 Entre 1830 y 1834, Michael FARADAY se dedica por completo al estudio sobre el fenómeno de la ELECTRÓLISIS, con el empleo de celdas electroquímicas determino que al paso de una carga eléctrica de 96487Coulumb (o un Faraday (1F) de carga) se deposita o libera un equivalente químico de sustancia, este hecho indicaba la existencia de una relación directa entre la electricidad y la materia, por lo tanto los átomos debían poseer una estructura de naturaleza eléctrica; Más tarde, entre 1884 y 1887, un joven Físico Sueco llamado Svante ARRHENIUS encaró el problema de la disolución de electrolitos (sustancias conductoras de la electricidad), concluyendo que cuando un electrolito se disuelve en agua son dispersadas por esta, en iones con carga positiva (+) y carga negativa ( - ), este aporte fué determinante para la comprensión de las leyes de Faraday, encontrándose que los iones en disolución poseen siempre "múltiplos de una cantidad fundamental", a la que en 1891 G. J. STONEY propone el nombre de "ELECTRÓN".
Entre 1830 y 1834, Michael FARADAY se dedica por completo al estudio sobre el fenómeno de la ELECTRÓLISIS, con el empleo de celdas electroquímicas determino que al paso de una carga eléctrica de 96487Coulumb (o un Faraday (1F) de carga) se deposita o libera un equivalente químico de sustancia, este hecho indicaba la existencia de una relación directa entre la electricidad y la materia, por lo tanto los átomos debían poseer una estructura de naturaleza eléctrica; Más tarde, entre 1884 y 1887, un joven Físico Sueco llamado Svante ARRHENIUS encaró el problema de la disolución de electrolitos (sustancias conductoras de la electricidad), concluyendo que cuando un electrolito se disuelve en agua son dispersadas por esta, en iones con carga positiva (+) y carga negativa ( - ), este aporte fué determinante para la comprensión de las leyes de Faraday, encontrándose que los iones en disolución poseen siempre "múltiplos de una cantidad fundamental", a la que en 1891 G. J. STONEY propone el nombre de "ELECTRÓN".
 |
| Celda electrolítica de Faraday |
 Entre 1830 y 1834, Michael FARADAY se dedica por completo al estudio sobre el fenómeno de la ELECTRÓLISIS, con el empleo de celdas electroquímicas determino que al paso de una carga eléctrica de 96487Coulumb (o un Faraday (1F) de carga) se deposita o libera un equivalente químico de sustancia, este hecho indicaba la existencia de una relación directa entre la electricidad y la materia, por lo tanto los átomos debían poseer una estructura de naturaleza eléctrica; Más tarde, entre 1884 y 1887, un joven Físico Sueco llamado Svante ARRHENIUS encaró el problema de la disolución de electrolitos (sustancias conductoras de la electricidad), concluyendo que cuando un electrolito se disuelve en agua son dispersadas por esta, en iones con carga positiva (+) y carga negativa ( - ), este aporte fué determinante para la comprensión de las leyes de Faraday, encontrándose que los iones en disolución poseen siempre "múltiplos de una cantidad fundamental", a la que en 1891 G. J. STONEY propone el nombre de "ELECTRÓN".
Entre 1830 y 1834, Michael FARADAY se dedica por completo al estudio sobre el fenómeno de la ELECTRÓLISIS, con el empleo de celdas electroquímicas determino que al paso de una carga eléctrica de 96487Coulumb (o un Faraday (1F) de carga) se deposita o libera un equivalente químico de sustancia, este hecho indicaba la existencia de una relación directa entre la electricidad y la materia, por lo tanto los átomos debían poseer una estructura de naturaleza eléctrica; Más tarde, entre 1884 y 1887, un joven Físico Sueco llamado Svante ARRHENIUS encaró el problema de la disolución de electrolitos (sustancias conductoras de la electricidad), concluyendo que cuando un electrolito se disuelve en agua son dispersadas por esta, en iones con carga positiva (+) y carga negativa ( - ), este aporte fué determinante para la comprensión de las leyes de Faraday, encontrándose que los iones en disolución poseen siempre "múltiplos de una cantidad fundamental", a la que en 1891 G. J. STONEY propone el nombre de "ELECTRÓN". |
| Tubo de Crookes |
Por el año 1850 Sir William CROOKES inicio diferentes trabajos relacionados con la descarga eléctrica en gases a través de tubos de vacío, el cual culminó por 1879 descubriendo los RAYOS CATÓDICOS. El material del tubo de vacío de vidrio presenta dos placas metálicas opuestas a modo de electrodos (ánodo y cátodo) las cuales se pueden conectar a los polos de un generador, cuando el gas esta a 760,0mmHg de presión no se observa nada, aún con potenciales de 10kV entre el cátodo y ánodo, sin embargo al hacerle vacío, manteniendo el alto voltaje (10kV) y descendiendo la presión, el gas comienza a conducir la electricidad produciéndose emisión de LUZ, pero al descender la presión entre 0,01mmHg a 0,001mmHg la "luz desaparece", bajo estas circunstancias se observa una débil fluorescencia en la pared del tubo opuesto al cátodo, esta fluorescencia de acuerdo a la sugerencia de los científicos de la época es producida por una radiación invisible que salía del cátodo, por lo que a estas radiaciones le denominarón RAYOS CATÓDICOS; Su existencia fué demostrada en 1895 por el Físico - Químico Francés J. B. PERRIN. En Octubre de 1897, J. J. THOMSON indicaría que dichos rayos no eran más que los electrones de STONEY viajando del cátodo al ánodo a altas velocidades, al cual THOMSON los denominaría "CORPUSCULOS" y no electrones cuyo significado era aplicado en las Soluciones, pero para sus contemporáneos, estos rayos eran torrentes de moléculas ionizadas o fluctuaciones producidas en el ETER el cual era el medio inmaterial del espacio responsable de la propagación de la luz.
Por medio de diversas experiencias los Rayos Catódicos presentan las siguientes propiedades:
- Se propagan en línea recta.
- Son corpúsculos materiales, esto se demuestra al colocar un molinete en el interior del tubo cerrando el circuito el molinete comenzara a moverse.
- Poseen carga eléctrica, se demuestra al colocar un imán los cuales desvíaran los rayos, mientras que en un campo eléctrico los rayos son desviados hacía el polo positivo, este hecho demostraba su carga eléctrica negativa por tanto se trataba del ELECTRÓN.
 |
| Esquema básico del fenómeno fotoeléctrico |
En 1887, el Físico Alemán Heinrich B. HERTZ descubrió de forma accidental cuando investigaba las ondas electromagnéticas predichas por MAXWELL, un fenómeno el cual observo cuando sobre una lámina de metal incidia una radiación, éste metal emitia también radiaciones. J. J. THOMSON también observaría que cuando la luz de alta energía incide en la superficie de ciertos metales como el Cinc (Zn) esta superficie metálica emite también radiaciones semejantes a los rayos catódicos, es decir con carga eléctrica negativa, a los que denominó "fotoelectrones" y al fenómeno EFECTO FOTOELÉCTRICO. Estas observaciones concluyen que la lámina metálica está constituida por átomos siendo los fotoelectrones parten de estos, por lo que no habría duda al deducir que los átomos están constituidos por partículas subatómicas.
 |
| Esquema de Millikan |
J.J. THOMSON estudió a los electrones cuantitativamente determinando que estos se desplazan con una velocidad de 2,8x109cm/s y en 1897 determinó la relación entre la carga (q) del electrón y su masa (m) la cual resulto ser: 1,75x108Coulumb/g (ó 5,304x1017u.e.c/g; donde: u.e.c es unidad electrostática de carga). En 1909 el Físico Norteamericano Robert Andrews MILLIKAN midió la carga del electrón estudiando la velocidad de caída de una gota de aceite (razón por el cual a su experimento se le denominó: "gota de aceite") y la aceleración (o desaceleración) que se producían cuando se aplican campos eléctricos, encontrándose como resultado de su trabajo que todas las gotas presentaban cargas cuyos valores eran múltiplos de una carga fundamental, era, la carga del electrón, cuyo valor fué de: 1,591x10-19Coulumb (C) (ó 4,802x10-10u.e.c), al reemplazar de la relación carga - masa del electrón de THOMSON se encuentra la masa del electrón la cual resultó: 9,05x10-28g, sin embargo en la actualidad con el uso de la tecnología más sofisticada se ha establecido que la carga del electrón es 1,6022x10-19C y su masa en gramos es 9,1095x10-28g.
MODELO ATÓMICO DE JOSEPH JOHN THOMSON
 Este modelo de átomo por la apariencia que nos muestra se ha denominado "Budín con pasas (o uvas en gelatina)", los electrones corresponden a las pasas, mientras que la esfera de electricidad positiva corresponde al budín en la cual las pasas están incrustadas. THOMSON intuía que su modelo era insuficiente, así la suposición de una esfera con electricidad positiva era muy simple, no muy definida, pero su existencia permitia neutralizar la carga negativa de los electrones, pues el átomo es eléctricamente neutro. Aún así éste modelo resultó ser útil pues se constituia en el primer intento para explicar la relación entre los electrones y la estructura atómica (es el primer modelo atómico), además de sugerir claramente la dependencia de la relación periódica de las propiedades de los elementos con los grupos de electrones presentes en el átomo. J. J. THOMSON en 1906 es galardonado con el premio Nobel de Física por su trabajo sobre la conducción de la electricidad a través de los gases.
Este modelo de átomo por la apariencia que nos muestra se ha denominado "Budín con pasas (o uvas en gelatina)", los electrones corresponden a las pasas, mientras que la esfera de electricidad positiva corresponde al budín en la cual las pasas están incrustadas. THOMSON intuía que su modelo era insuficiente, así la suposición de una esfera con electricidad positiva era muy simple, no muy definida, pero su existencia permitia neutralizar la carga negativa de los electrones, pues el átomo es eléctricamente neutro. Aún así éste modelo resultó ser útil pues se constituia en el primer intento para explicar la relación entre los electrones y la estructura atómica (es el primer modelo atómico), además de sugerir claramente la dependencia de la relación periódica de las propiedades de los elementos con los grupos de electrones presentes en el átomo. J. J. THOMSON en 1906 es galardonado con el premio Nobel de Física por su trabajo sobre la conducción de la electricidad a través de los gases.
 |
| (1 856 - 1 940) |
Ante las evidencias experimentales desarrolladas, era evidente que los rayos catódicos se producían de modo independiente al metal empleado en el cátodo del tubo, por lo que el Físico Inglés J. J. THOMSON de Cavendish, postuló en 1904, que la materia contenía en su estructura interna CORPUSCULOS de carga NEGATIVA, que como se indicará, STONEY le denominaría ELECTRONES, ante esto THOMSON propuso un modelo de átomo bajo los siguientes términos: "Suponemos que el átomo está constituido por electrones de movimiento vibratorio en una esfera de electrificación positiva uniforme... los electrones se distribuirán por si mismos en series... el cambio gradual de las propiedades de los elementos que ocurre a medida que nos desplazamos por las filas horizontales en la tabla periódica de los elementos, también está ilustrado por las propiedades que poseen estos grupos de electrones".
 Este modelo de átomo por la apariencia que nos muestra se ha denominado "Budín con pasas (o uvas en gelatina)", los electrones corresponden a las pasas, mientras que la esfera de electricidad positiva corresponde al budín en la cual las pasas están incrustadas. THOMSON intuía que su modelo era insuficiente, así la suposición de una esfera con electricidad positiva era muy simple, no muy definida, pero su existencia permitia neutralizar la carga negativa de los electrones, pues el átomo es eléctricamente neutro. Aún así éste modelo resultó ser útil pues se constituia en el primer intento para explicar la relación entre los electrones y la estructura atómica (es el primer modelo atómico), además de sugerir claramente la dependencia de la relación periódica de las propiedades de los elementos con los grupos de electrones presentes en el átomo. J. J. THOMSON en 1906 es galardonado con el premio Nobel de Física por su trabajo sobre la conducción de la electricidad a través de los gases.
Este modelo de átomo por la apariencia que nos muestra se ha denominado "Budín con pasas (o uvas en gelatina)", los electrones corresponden a las pasas, mientras que la esfera de electricidad positiva corresponde al budín en la cual las pasas están incrustadas. THOMSON intuía que su modelo era insuficiente, así la suposición de una esfera con electricidad positiva era muy simple, no muy definida, pero su existencia permitia neutralizar la carga negativa de los electrones, pues el átomo es eléctricamente neutro. Aún así éste modelo resultó ser útil pues se constituia en el primer intento para explicar la relación entre los electrones y la estructura atómica (es el primer modelo atómico), además de sugerir claramente la dependencia de la relación periódica de las propiedades de los elementos con los grupos de electrones presentes en el átomo. J. J. THOMSON en 1906 es galardonado con el premio Nobel de Física por su trabajo sobre la conducción de la electricidad a través de los gases. 










Comentarios